عناصر گروه هفتم (اصلی) هالوژنها
عناصر این گروه به ترتیب عبارتند از : فلوئور F ، کلر Cl، برم Br ، ید I ، استانین At. شعاع اتمی این عناصر با افزایش عدد اتمی (از بالا به پائین) زیاد می شود انرژی یونیزاسیون کم شده الکترونگاتیوی نیز کم می شود نقاط ذوب و جوش بیشتر شده. پتانسیل اکسیداسیون آنها به ترتیب کاهش
می یابد و هر کدام در لایه آخر 7 الکترون (s2p5) دارند، با فلزات میل
ترکیبی شدید دارند و مولکول حاصل از آنها اغلب خصلت یونی دارد مانند
NaF و KCl و BaI2 . با هیدروژن هالدیدئیدروژن می دهند که پس از حل شدن در آب محلول اسید به وجود می آورند مانند HCl و HI. از بالا به پائین خواص غیر فلزی ضعیف تر می شود غیر فلز بالاتر می تواند غیر فلز پائین تر را از نمکش بیرون کرده و هالوژن آزاد نماید . مثلاً:
KCl + Br --------> عملی نیست
ولی از تأثیر کلر بر نمک Br، برم حاصل می شود:
2KBr + Cl2 ----------->2 KCl + Br2
بنابراین از لحاظ فعالیت شیمیایی ترتیب زیر برقراراست:
F۲>Cl۲>Br۲>I۲>As
فلوئور و کلرگازی شکلند، برم مایع و ید جامد است که خیلی زود به حالت بخار در می آیند به همین دلیل آنها را به صورت F2, Cl2,Br2,I2 نشان می دهند.
فلوئور در تمام ترکیبات یک ظرفیتی است ولی سایر هالوژنها می توانند ظرفیت های مختلف در ترکیبات داشته باشن زیرا در فلوئور فقط یک الکترون منفرد در اوربیتال 2p وجود دارد و به هیچ وجه نمی تواند حالت برانگیخته پیدا کند ولی در سایر هالوژنها ، الکترونها حالت برانگیخته پیدا می کنند و الکترونهای منفرد زیاد تر ایجاد می گردد. مثلاً: اتم کلر 17Cl در ترکیب با فلوئور 9F ممکن است CLF و ClF3 و ClF5 و ClF7 بدهد در هر ترکیب حالت برانگیخته الکترونها را در اوربیتال 3d می توان توجیه کرد.
هالوژنها چون میل ترکیبی زیادی با عناصر دیگری دارند در طبیعت به حالت آزاد وجود ندارد ولی به صورت ترکیب فراوان هستند این عناصر اغلب سمی و خطرناکند در حالیکه ترکیبات آنها بسیار مفید و با ارزش هستند و کاربرد آنها در صنایع مختلف زیاد است مانند گاز فریون CF2Cl2 که در یخسازی به کار می رود پی وی سی و د.د.ت (دی کلر ـ دی فنیل تری کلرواتان)، کلروفرم ، .... سایر ترکیبات فلوئور برم و ید که در انواع داروها و ترکیبات مختلف مورد استفاده قرار می گیرند.
برای تهیه ی هالوژنها از نمک های آنها استفاده می کنند فقط فلوئور را از الکترولیز KHF2 یا (KF.HF) بدست می آورند. بقیه هالیدها با اسید سولفوریک و دی اکسید منگنز هالوژن می دهند مثلاً: طرز تهیه ید از یدید سدیم:
2NaI + H2SO4 + MnO2 -------> MnSO4 + 2NaHSO4 + I2 + 2H2O
از تاثیر گاز کلر بر یدیدها نیز می توان ید بدست آورد یا از تاثیر گاز کلر بر برمیدها برم حاصل می شود. فلوئور اکسید کننده ایست شدید و کلر نیز اکسید کننده است برم و ید هم خاصیت اکسید کنندگی و هم خاصیت احیا کنندگی دارند مثال:
2KI + Cl2 ------> 2KCl + I2
3I2 + 2Al ------> 2AlI3
که در اولی ید اکسید شده و در دومی ید احیاء شده است.
به واکنش هایی که در آن ید اکسید می گردد یعنی از محلول یدیدها ید آزاد می گردد یدومتری گویند.
2KI + H2O2 + H2SO4 -------> I2 + K2SO4 + H2O
تذکر: ارزش حجمی آب اکسیژنه (پر اکسید هیدروژن) از رابطه a=N.Ev بدست می آید که a ارزش حجمی N نرمالیته Ev ای کی والان حجمی معادل 6/5 است.
هالیدهای ئیدروژن به ترتیب عبارتند از HF و HCl و HBr و HI که برای تهیه ی آنها از تاثیر اسید سولفوریک بر هالیدهای فلزی استفاده می کنند.
این مواد در آب حل شده تولید اسید می نمایند. فلوئوریدئیدرژن به علت داشتن پیوند ئیدروژنی استثنائاً نقطه ی جوش بالاتر دارد و در حالت عادی مایع است بقیه هالیدهای ئیدروژن با افزایش جرم مولکولی نقطه ی جوش بالاتر دارند به همین دلیل فلوئورید ئیدرژن به صورت H2F2 و همین ها به صورت زیروند 3 تا آخر وجود دارد.
هیدرواسید ها بر اغلب فلزات، ا کسیدها، بازها، کربناتها اثر کرده و نمک می دهند.
اسید فلوئوریدریک بر شیشه اثر می کند یعنی سیلیس SiO2 را در خود حل می نماید.
غیر از فلوئور، هالوژنها اکسی اسید (اسید اکسیژن دار) نیز تولید می کنند مانند KClO4 پر کلرات پتاسیم NaIO3 یدات سدیم NaBrO هیپو برومیت سدیم. هرچه تعداد اکسیژن در اکسی اسیدهای هالوژن بیشتر باشد، خاصیت اسیدی آن زیاد تر است زیرا اکسیژن از هالوژن الکترونگاتیوتر می باشد و زوج الکترونهای مشترک بین Cl و O را به طرف خود می کشد در نتیجه خروج الکترون مشترک بین H و O متوجه اکسیژن پیوندی هیدروژن و اکسیژن کاسته می گردد و پروتون (+H) آسانتر آزاد می گردد.
بنابر این از لحاظ اسیدی می توان گفت که:
HClO4 > HClO3 > HClO2 > HClO
عدد اکسیداسیون کلر در این ترکیبات به ترتیب 1،3،5،7 است و نمکهای این اسیدها به ترتیب هیپوکلریتها، کلریتها، کلراتها و پر کلراتها می باشند.
برای تشخیص یون فلوئور از یون ۲+ Ca و برای تشخیص یون کلرید از یون+ Ag استفاده می کنند:
Ca2+ + 2F- -----> CaF2
Ag+ + Cl- -------> AgCl
(یدیدها با کلرید و برمیدها با کلر. برم می دهند که قبلا گفته شد)
نکته مهم :
۱. اسیدهای هالوژنه با افزایش جرم مولکولی خاصیت اسیدی بیشتری پیدا می کنند و درجه تفکیک یونی آنها زیادتر است یعنی:
HI > HBr > HCl > HF
2. هالوژنها در آب حل می شوند و محلول رنگی بوجود می آورند (ید در حلالهای آلی حل می شود)
رنگ محلول بستگی به نوع هالوژن و نوع حلال دارد مثلا در تترا کلرید کربن ید بنفش، برم قرمز و کلر زرد می شود.
3. جدول مشخصات هالوژنها نشان می دهد که با کاهش عدد اتمی از ید تا کلر بر مقدار انرژی الکترون خواهی افزوده می شود ولی در مورد فلوئور از انرژی الکترون خواهی کاسته می گردد(به علت کوچک بودن حجم آن)
4. استاتین آخرین عنصر گروه هفتم از بمباران کردن بیسموت با اشعه آلفا بدست می آید که ایزوتوپهای زیادی دارد.
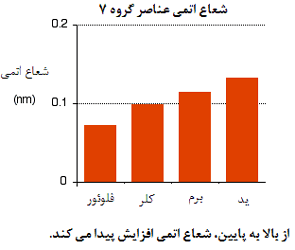
- توضیح علت افزایش شعاع اتمی
شعاع یک اتم توسط عامل های زیر کنترل می شود:
- تعداد لایه های الکترون های اطراف هسته
- کششی که الکترون های بیرونی تر از هسته احساس می کنند.
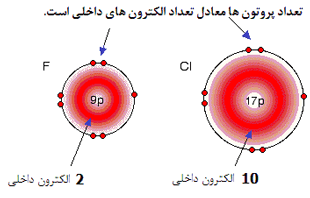
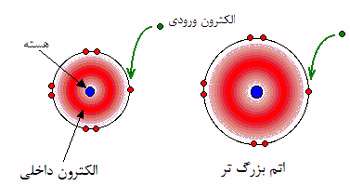
با مقایسه فلوئور و کلر، تعداد الکترون های هر لایه خواهد بود:
در هر مورد، الکترون های خارجی، کشش خالص +7 را از سوی هسته احساس می کنند. بار مثبت بر روی هسته توسط منفی بودن الکترون های داخلی کم می شود.
این روند برای تمام اتم های گروه 7 نیز صادق است.
بنابراین تنها عاملی که اندازه اتم را تحت تأثیر قرار می دهد، تعداد لایه های الکترون های داخلی است که باید در اطراف اتم جا بگیرند. بدیهی است که لایه های بیش تر الکترونی، جای بیش تری اشغال خواهد کرد (چون الکترون ها در این حالت، بیش تر همدیگر را دفع خواهند کرد). این به معنای آن است که با پایین رفتن در این گروه، اتم ها بزرگ تر شوند.
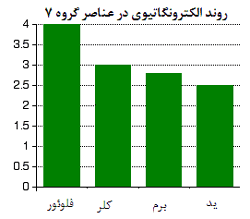
تغییرات الکترونگاتیوی:
الکترونگاتیوی، اندازه گیری تمایل یک اتم برای جذب جفت الکترون های پیوندی است. معمولا از مقیاس پالینگ برای اندازه گیری الکترونگاتیوی استفاده می شود که فلوئور، الکترونگاتیوترین عنصر جدول تناوبی است.
توجه کنید که با پایین رفتن در این گروه، الکترونگاتیوی کاهش پیدا می کند.
توضیح علت کاهش الکترونگاتیوی:
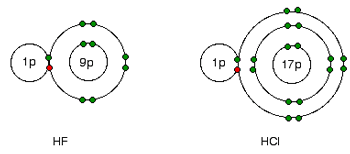
این علت به سادگی از شکل های فلوئورید هیدروژن و کلرید هیدروژن فهمیده می شود:
جفت های پیوندی الکترون ها بین هیدروژن و هالوژن، همان کشش خالص +7 را از هر دو اتم کلر و فلوئور احساس می کند. اما در مورد کلر، هسته دورتر از جفت پیوندی است. این به معنای آن است که کلر به شدت فلوئور، جذب نمی شود.
همچنان که هالوژن ها بزرگ تر می شوند، هر جفت پیوندی از هسته هالوژن دورتر می شود؛ بنابراین با قدرت کم تری جذب هسته اتم می شود. به بیان دیگر از بالا به پایین، الکترونگاتیوی کم می شود.
-
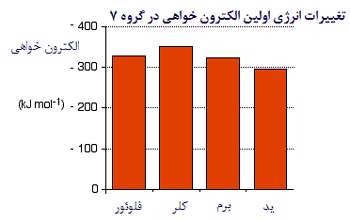
تغییرات اولین الکترون خواهی
اولین انرژی الکترون خواهی، انرژی آزاد شده ای است که 1 مول از اتم های گازی، یک الکترون به دست می آورد تا 1 مول از یون -1 تشکیل دهد:
وقتی این تغییر اتفاق می افتد، انرژی اولین الکترون خواهی، انرژی آزاد شده در هر مول اتم X است.
این انرژی، مقدار منفی دارد. برای مثال، اولین الکترون خواهی کلر، -394 KJ/mol است. طبق قرارداد، علامت منفی نشان دهنده آزاد شدن انرژی است.
توجه کنید که روند تغییرات الکترون خواهی در گروه، منظم نیست. به استثنای فلوئور، مقادیر الکترون خواهی کم تر می شود (گرمای کم تری آزاد می شود).
الکترون خواهی، اندازه گیری جاذبه بین الکترون ورودی به یک اتم و هسته است.جاذبه بیش تر به معنای الکترون خواهی بیش تر است.
در اتم بزرگ تر، جاذبه از هسته ای با بار مثبت بیش تر، توسط الکترون های محافظ خنثی می شود؛ بنابراین هر الکترون ورودی، اثر بار خالص +7 را از مرکز اتم احساس می کند؛ دقیقا مثل حالت شعاع اتمی یا الکترونگاتیوی.
وقتی اتم، بزرگ تر می شود، الکترون ورودی از هسته دورتر می شود و جاذبه کم تری احساس می کند. پس مقدار الکترون خواهی در این گروه از بالا به پایین کاهش می یابد.
اما چرا فلوئور فرق دارد؟
فلوئور، اتم بسیار کوچکی است، پس الکترون ورودی به هسته فلوئور بسیار نزدیک است. پس چرا الکترون خواهی آن از کلر کم تر است؟
در این مورد، عامل دیگری نقش دارد. وقتی الکترون تازه ای به یک اتم اضافه می شود، وارد فضایی با بار منفی زیاد به دلیل الکترون های موجود می شود. بنابراین دافعه ناشی از این الکترون ها مقداری از جاذبه هسته را خنثی می کند.
چون اتم فلوئور بسیار کوچک است، چگالی الکترونی بسیار بالاست. این به معنای آن است که دافعه زیاد است و چاذبه هسته را آن قدر کم می کند که الکترون خواهی فلوئور کم تر از کلر باشد.

















 قلمرو شیمی به گستردگی جهان هستی است . شیمی یکی از مهمترین علوم پایه است که نقش کلیدی در زندگی بشر امروزی دارد و هر جنبه از زندگی ما ارتباط نزدیکی با این علم دارد. امید است اینجانب بتوانم سهمی هر چند اندک در معرفی و آموزش علم شیمی داشته باشم . از ارائه نظرات پر بار شما عزیزان در هر چه بهتر شدن این وبلاک کمال تشکر را دارم.
قلمرو شیمی به گستردگی جهان هستی است . شیمی یکی از مهمترین علوم پایه است که نقش کلیدی در زندگی بشر امروزی دارد و هر جنبه از زندگی ما ارتباط نزدیکی با این علم دارد. امید است اینجانب بتوانم سهمی هر چند اندک در معرفی و آموزش علم شیمی داشته باشم . از ارائه نظرات پر بار شما عزیزان در هر چه بهتر شدن این وبلاک کمال تشکر را دارم.